VIII抗HIV薬の作用機序と薬物動態
1.抗HIV薬の作用機序
(1)HIVの増殖サイクル
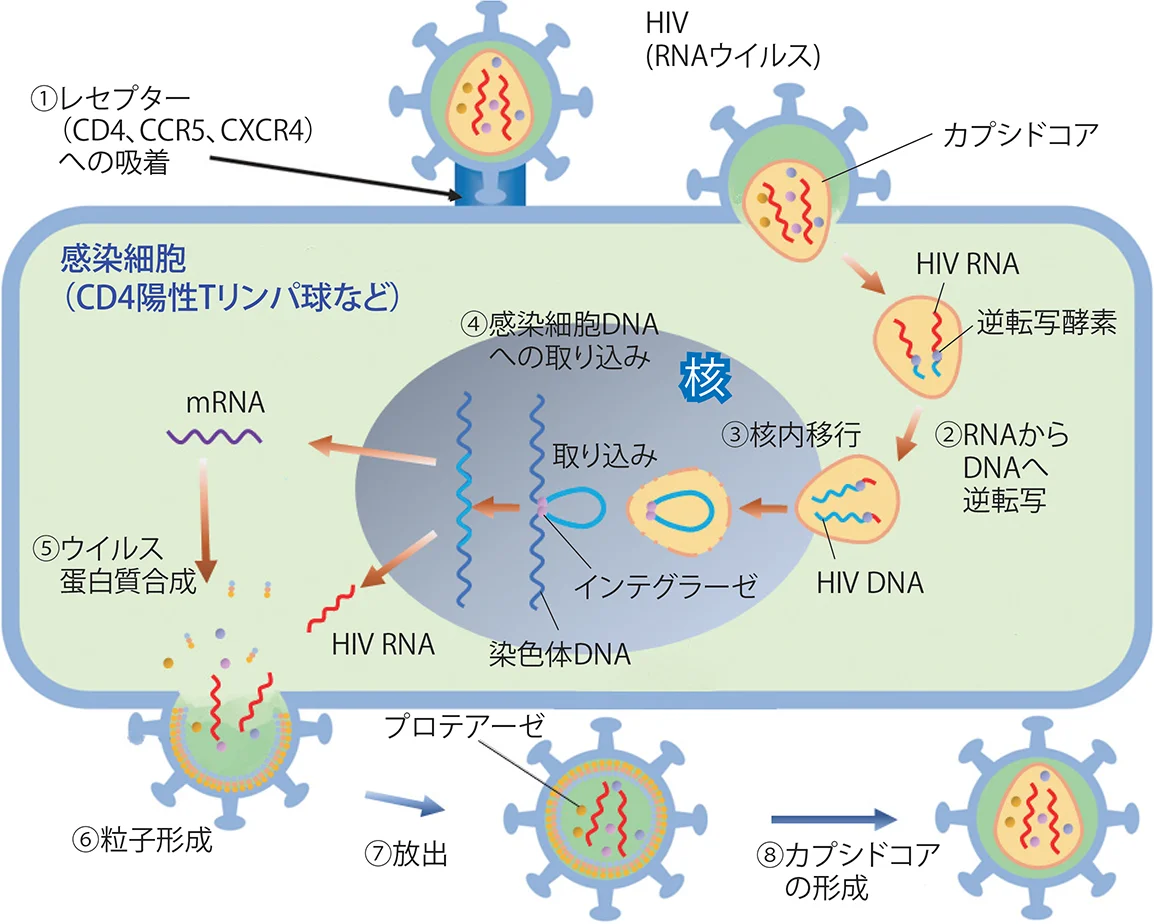
HIVはRNAウイルスである。HIV粒子はレセプターを介して宿主細胞(主にCD4陽性Tリンパ球とマクロファージ)に侵入し、宿主細胞内でHIV自身の逆転写酵素によってRNAからDNAに逆転写される。逆転写されたDNAは宿主細胞の核内でHIV自身のインテグラーゼによって宿主DNAに組み込まれる。宿主細胞に組み込まれたウイルスDNAをもとに、転写・翻訳を経て様々なウイルスの構成要素(RNAゲノム、宿主細胞由来のtRNA、Envタンパク質、Gagポリタンパク質、ウイルスプロテアーゼ、逆転写酵素、インテグラーゼなど)が形成され、細胞膜上に集合してウイルス粒子を放出する。放出されたウイルス粒子はプロテアーゼ(タンパク分解酵素)により複合タンパクが切断されて、カプシドコアなどを形成し、成熟したHIV粒子となる(図VIII-1)。
HIVの増殖サイクルを中断させる薬剤はすべて抗HIV作用を持つことになるが、正常細胞の増殖に必須のステップ(転写・翻訳など)に影響を与える薬剤は治療薬として使用することはできない。現在国内で承認されている抗HIV薬の作用点としては、HIV粒子と細胞表面レセプターとの結合・膜融合、逆転写、核内移行、逆転写産物の宿主DNAへの組み込み、ウイルス粒子の形成と放出、プロテアーゼによる切断、カプシドコアの形成である。逆転写を阻害する逆転写酵素阻害剤は、さらに核酸系逆転写酵素阻害剤と非核酸系逆転写酵素阻害剤に大別される。
図VIII-1 HIVの増殖サイクル
(2)核酸系逆転写酵素阻害剤(NRTI)
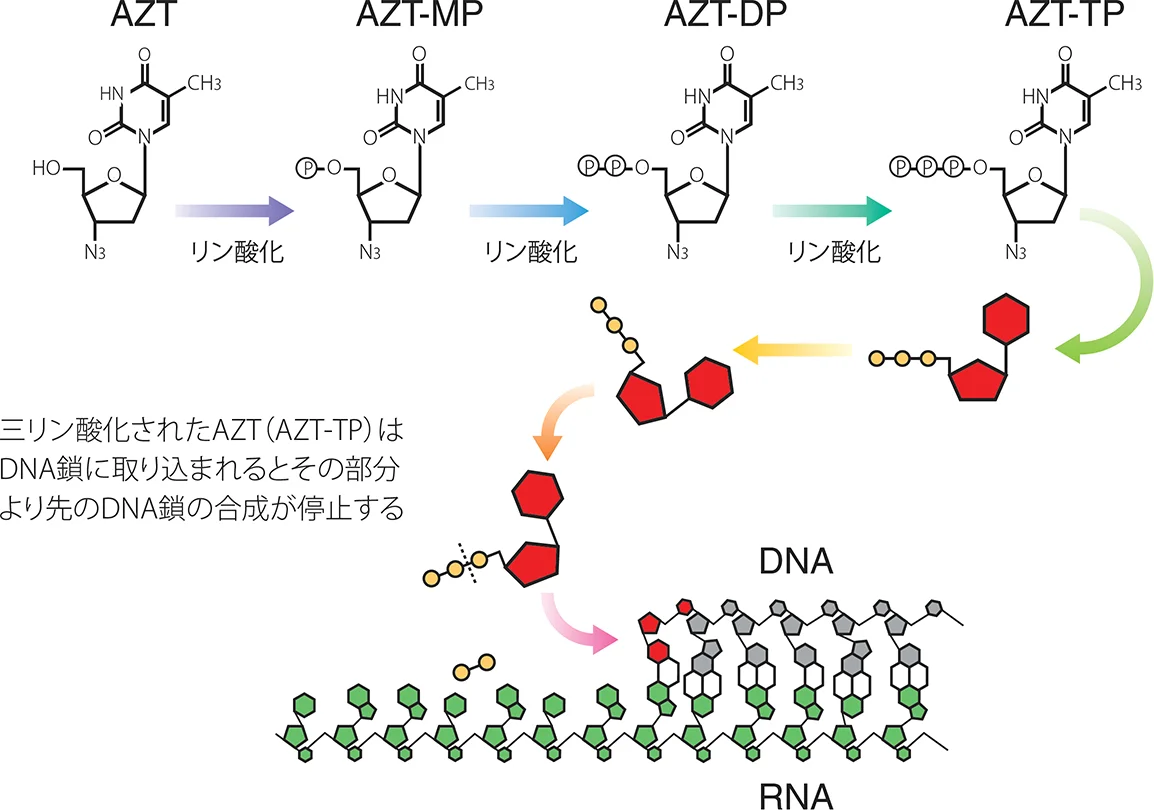
ヌクレオシド系逆転写酵素阻害剤は、五炭糖の3'部分の水酸基を欠いた修飾ヌクレオシドである。本系統の薬剤は細胞内でリン酸化酵素によりリン酸基が付加され活性型であるヌクレオチド型となる。これが逆転写酵素により伸張しつつあるHIVのDNA鎖内に正常のヌクレオチドの代わりに組み込まれるが、五炭糖の3'部分の水酸基を欠いているため、次に結合すべきヌクレオチドが結合できなくなり、ウイルスDNAはそれ以上伸長することができなくなる。ジドブジン(AZT)を例として作用機序の模式図を示す(図VIII-2)1)。2024年3月現在、ジドブジン(Zidovudine: AZT(ZDV), 商品名レトロビル)、ラミブジン(Lamivudine: 3TC, 商品名エピビル)、アバカビル(Abacavir: ABC, 商品名ザイアジェン)、テノホビルジソプロキシルフマル酸塩(Tenofovir disoproxil fumarate: TDF, 商品名ビリアード®)、エムトリシタビン(Emtricitabine: FTC)が国内において承認されている。NRTI配合剤としては、AZT/3TCの合剤(商品名コンビビル)、ABC/3TCの合剤(商品名 先発品エプジコム、後発品 ラバミコム®)、TDF/FTCの合剤(商品名ツルバダ®)、テノホビルアラフェナミドフマル酸塩(Tenofovir alafenamide fumarate: TAF)/FTCの合剤(商品名デシコビ®)が承認されている。TDF、TAF共にテノホビル(Tenofovir: TFV)のプロドラッグではあるが、TAFはTDFと比較して効率的に標的細胞内に移行するため、低用量でTDFと同等の抗HIV活性を示す。
宿主のミトコンドリアDNA合成を担当するDNAポリメラーゼγは、核酸系逆転写酵素阻害剤を基質として取り込む傾向を持つので、本薬剤によりミトコンドリアの増殖が障害されることがある。NRTIの副作用である貧血や末梢神経障害・乳酸アシドーシスは、ミトコンドリア障害によるものと考えられている。なお、TDFおよびTAFは、ヌクレオシドがすでに1リン酸化された修飾ヌクレオチド構造を持ち、同様に逆転写酵素阻害作用を有する。構造から厳密にはヌクレオチド系に属するが便宜上、本薬剤も核酸系逆転写酵素阻害剤に分類されている。
図VIII-2 ジドブジン(AZT)の作用機序
(3)非核酸系逆転写酵素阻害剤(NNRTI)
自然界に存在する物質や合成化合物の中には、上記とは異なるメカニズムで逆転写酵素阻害活性を持つものがある。化学構造や作用機序に共通点があり、一括して非核酸系逆転写酵素阻害剤(NNRTI)と呼ばれている。本系統の薬剤はヌクレオシドの基本骨格を持たず、逆転写酵素の活性中心の近傍に結合してアロステリックに酵素活性を阻害するという共通の特徴がある。2024年3月現在、ネビラピン(Nevirapine: NVP, 商品名ビラミューン®)、リルピビリン(Rilpivirine: RPV, 商品名エジュラント®、リカムビス®)、ドラビリン(Doravirine: DOR, 商品名ピフェルトロ®)が承認されている。RPVの経口剤はTAF/FTCとの合剤(商品名オデフシィ®)が承認されている。RPVの持効性懸濁注射液であるリカムビス®水懸筋注は、半減期が60.7日と長時間作用型の製剤であるため2)、後述のカボテグラビル筋注製剤と併用して1ヵ月または2ヵ月毎に筋注する。
1つの薬剤に対して耐性を獲得したHIVは、他の薬剤に対しても交叉耐性を示すことがある。DORは、既知のNNRTIの主な耐性変異部位であるK103およびY181における変異の影響を受けにくい構造を有している。そのため、NNRTI耐性ウイルスに対して高い活性を示すNNRTIであり、NRTI 2剤と併用して、1日1回の経口投与で食事の有無に関わらず使用できる。
(4)プロテアーゼ阻害剤(PI)
HIVの機能タンパクは、まず複合タンパクとして産生され、HIV自身のプロテアーゼによって特定の部位で切断されてはじめて機能を発揮する。プロテアーゼ阻害剤(PI)は、プロテアーゼの酵素活性部位に結合し、その活性を消失させる。その結果ウイルスは完成型となれず、感染力を失う。2024年3月現在、リトナビル(Ritonavir: rtv, 商品名ノービア®)、ロピナビル/リトナビル配合剤(Lopinavir/Ritonavir: LPV/rtv, 商品名カレトラ®)、ダルナビル(Darunavir: DRV, 商品名プリジスタ®)およびダルナビルとブースターであるコビシスタット(Cobicistat: cobi)との合剤(Darunavir/Cobicistat: PCX, 商品名プレジコビックス® )が承認されている。PIのシングルタブレットレジメン(STR)としては、DRV/cobi/TAF/FTCの合剤(商品名シムツーザ®)が承認されている。
PIには吸収の悪い薬剤や、溶解性や溶出性を高めるために比較的多めの添加物を使用した薬剤がある。服用すべき錠剤の数が多いものもあるが、近年はSTRの発売など服薬負担が軽減されている。PIの多くは肝臓や小腸粘膜にあるCYP3A4などの代謝酵素の活性を抑制し、他の薬剤の血中濃度に大きな影響を及ぼす。このため、PIを含むARTを行う際には、患者の服用しているすべての薬剤を(健康食品を含め)把握する必要がある。
(5)インテグラーゼ阻害剤(INSTI)
HIVインテグラーゼは、HIV遺伝子にコードされたウイルス複製に必要な酵素であり、インテグラーゼ阻害剤(INSTI)は、HIVインテグラーゼの触媒活性を阻害する3)。インテグラーゼはHIVの複製に欠かせない酵素の一つとされ、HIV遺伝子断端を組み込み反応の基質として活性化処理する3'プロセッシング活性と組み込み酵素活性の、少なくとも2つの酵素活性があるとされている4)。2024年3月現在、ラルテグラビル(Raltegravir: RAL, 商品名アイセントレス®)、エルビテグラビル(Elvitegravir: EVG)、ドルテグラビル(Dolutegravir: DTG)、ビクテグラビル(Bictegravir: BIC)、カボテグラビル(Cabotegravir: CAB、商品名ボカブリア)が使用可能である。EVGはEVGの血中濃度を上昇させる働きを持つcobiとTAF、FTCとの合剤(商品名ゲンボイヤ®)が承認されている。BICはTAF、FTCの合剤(商品名ビクタルビ®)が承認されている。
DTGはドルテグラビル単剤(商品名テビケイ)、DTGとABC、3TCの合剤(商品名トリーメク)に加え、DTGとRPVの合剤(商品名ジャルカ)が承認されている。また、長期服用に伴う副作用軽減等の回避として、2剤併用療法のDTGと3TCの合剤(商品名ドウベイト)が承認されている。
CABは内服薬のボカブリア錠と長時間作用型注射剤のボカブリア水懸筋注が承認されている。CAB30mgを単回経口投与した時の半減期は37〜41時間であるが、持効性懸濁注射液のCAB筋注製剤の半減期は38.3日と長時間であるため5)、RPV筋注製剤と併用して1ヵ月または2ヵ月毎の投与が可能である。
(6)侵入阻害剤(CCR5阻害剤)
CCR5阻害剤は、HIVが細胞に侵入する際に利用する補受容体のC-Cケモカイン受容体5(C-C chemokine receptor 5: CCR5)を阻害する薬剤である。HIV-1がCD4陽性細胞に侵入する際、まずHIV-1エンベロープ糖蛋白のgp120がCD4と結合する。続いて、gp120-CD4複合体がCD4陽性細胞の細胞膜上にあるヒトケモカイン受容体のCCR5またはCXCR4に選択的に結合し、それによってHIV-1エンベロープ糖蛋白のgp41の反応を引き起こす。その結果、HIV-1エンベロープとCD4陽性細胞の細胞膜が融合し、HIV-1内容物がCD4陽性細胞に侵入する。CCR5阻害剤はCCR5に選択的に結合してその立体構造を変化させ、gp120-CD4複合体とCCR5の結合を阻害することで、CCR5指向性HIV-1の細胞内への侵入を阻害する。2024年3月現在、マラビロク(Maraviroc: MVC, 商品名シーエルセントリ®)が承認されている。MVCはCXCR4指向性およびCCR5/CXCR4二重指向性HIV-1の細胞内への侵入は阻害しない6)。従って、患者の持つウイルスの指向性を検査したうえで使用する必要がある。
(7)カプシド阻害剤(CAI)
HIVのゲノム(RNA)は円錐形の殻(カプシドコア)の中に収められている。このカプシドはタンパク質で構成され、RNAを保護するとともに、感染先細胞にRNAを運ぶ役割を担っている。カプシド阻害剤(CAI)のレナカパビル(Lenacapavir:LEN, 商品名シュンレンカ®)は、HIV-1のカプシド蛋白単量体間の界面に直接結合し、HIV-1プロウイルスDNAのカプシド介在性核内移行を阻害する。また、ウイルスの形成・放出段階において、細胞膜に集合するカプシド前駆体タンパク質に結合して不安定化することによって、ウイルス形成と放出を阻害する。さらにカプシドコアの形成を阻害することによりHIV粒子の成熟を阻害する。このようにLENはウイルス複製に関与するHIV-1カプシドタンパクの機能を阻害することによりHIVの増殖を抑える7)。LENは内服薬のシュンレンカ錠と長時間作用型注射剤のシュンレンカ皮下注が承認されている。
LENを経口投与したときの絶対バイオアベイラビリティは約6~10%と低いが、皮下投与では完全に吸収される。半減期は長く、経口剤では10.1日、皮下注では80.8日である。