IV抗HIV治療の開始時期(成人、慢性期)
本章は、慢性期の成人HIV感染者に対する初回治療の開始時期について記述している。急性HIV感染症については第XIV章を参照されたい。
要約
- CD4数に関わらずすべてのHIV感染者に抗HIV治療の開始を推奨する(AI)。
- 治療開始にあたっては、服薬遵守の重要性を教育することや医療費減免のための社会資源の活用方法などについても詳しく説明しておかなければならない。早期の治療開始が推奨される近年においてはこれらの点への対応が以前にも増して重要となっている。
1.治療開始時期と治療成績
前章で述べたように、現在の抗HIV薬による治療ではHIVを駆逐するためには数十年間治療を継続する必要があると考えられており(表III-2)、それ以前に治療を中断すればHIVは再増殖し治療前の状態に戻ってしまう。このことは、患者はほぼ生涯にわたって治療を継続する必要があることを意味し、それに伴うQOLの低下、経済的負担、治療薬による副作用など様々な問題が生じる。したがって、いつ治療を開始すべきかについては、“治療効果”という正の側面と“長期毒性”などの負の側面とのバランスをどのように考えるかにより決定されねばならない。“治療効果”の指標となるのは、AIDS発症阻止と生命予後の改善である。以下にこの2点に関して、過去の臨床統計から明らかとなったエビデンスを示す。
(1)治療開始時期の参考となるパラメーター
慢性期の無症候性HIV感染症患者に対して治療開始時期を決める重要なパラメーターは、CD4陽性Tリンパ球数(以下、CD4数)と血中HIV RNA量であった。前章で解説したように、血中HIV RNA量とCD4数の減少速度はある程度の相関はあるが、患者ごとのばらつきが大きい(図III-2)。
HIV感染症の病態が「CD4陽性Tリンパ球を中心とする免疫の破綻」であることから、開始基準としてはCD4数がより重要視されてきた。海外のガイドライン(DHHSガイドライン1)、European AIDS Clinical Society(EACS)ガイドライン2)、International AIDS Society(IAS)-USA Panelガイドライン3))でも過去には第一のパラメーターとしてはCD4数が指標となってきた。
治療開始時の血中HIV RNA量について、10万コピー/mL以上の群は10万コピー/mL未満の群に比較して治療後の生命予後が低下することが3つのグループから報告されている4-6)。しかしながら、患者を治療開始時のCD4数によって200/μL以上の群に限定すれば、血中HIV RNA量が10万コピー/mL以上と未満の群の生命予後に統計学的な有意差は得られていない7)。この報告では、血中HIV RNA量を5万コピー/mLおよび20万コピー/mLでも分けて解析しているが、いずれも生命予後に有意差は認められていない。
(2)未治療で経過観察した場合のHIV感染者のエイズ発症率
Mellorsらは、抗HIV療法を行っていないHIV感染者が3年後にAIDSを発症(AIDS指標疾患発症、表III-1参照)する頻度を、フォローアップ開始時のCD4数と血中HIV RNA量ごとに分けて解析している8)。表IV-1に示すように、3年後のAIDS発症リスクはCD4数が少ないほど高く、血中HIV RNA量が多いほど高い。3年後のAIDS発症リスクが30%を超えるのは、CD4数が350/μL以下、あるいは血中HIV RNA量55,000コピー/mL以上の患者群である。
| CD4陽性Tリンパ球数(/μL) | ||||||
|---|---|---|---|---|---|---|
| >750 | 750-501 | 500-351 | 350-201 | ≦200 | ||
| ウイルス量 | <1.5K | ND | 3.7 | ND | ND | ND |
| 1.5K-7K | 2 | 2 | 2 | ND | ND | |
| 7K-20K | 3.2 | 8.1 | 8.1 | 8.1 | ND | |
| 20K-55K | 9.5 | 16.1 | 16.1 | 40.1 | 40.1 | |
| >55K | 32.6 | 32.6 | 42.9 | 64.4 | 85.5 | |
(3)ARTを開始した場合のHIV感染者の生命予後
治療開始後の生命予後を左右する要因の一つとして、ART後のCD4数の回復の程度が挙げられる。Mooreらによれば、治療開始後のCD4数の回復は、開始前のCD4数が350/μL以上と未満の群とで明確な差異があり、CD4数が349/μL以下で治療を開始した症例では、CD4数が正常域まで回復することは期待できない(図IV-1)9)。7年間のARTを行った患者を対象としたデータでも、治療前のCD4数がその後のCD4数の回復に大きく影響することが示されている10)。
図IV-1 ART開始時のCD4数と治療後のCD4数の推移
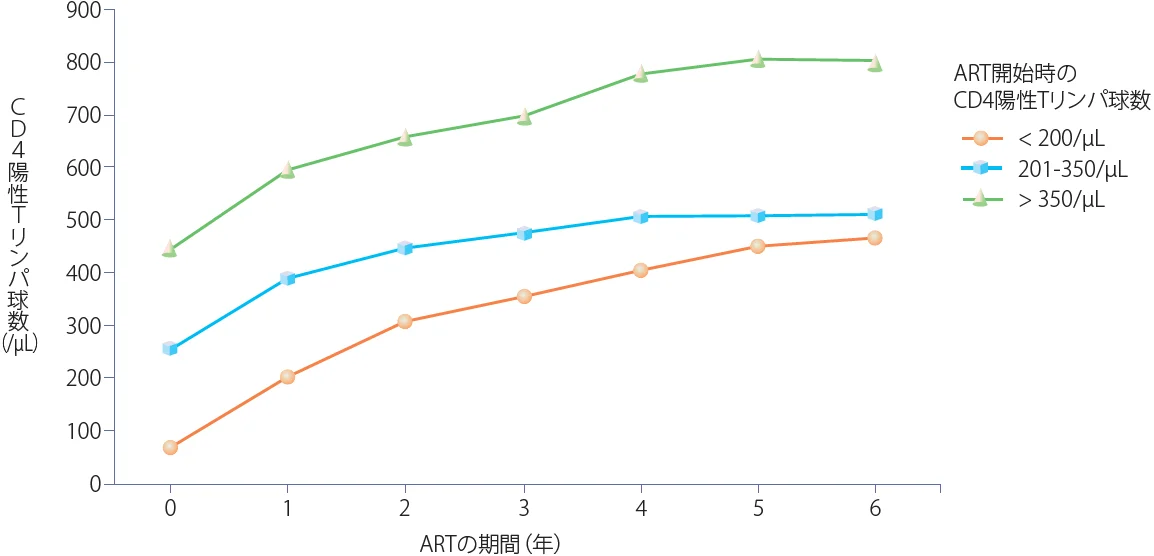
1年以上ARTを行いウイルス量が400コピー/mL未満の280症例を平均1,430日(366-3,500日)フォローした。
Moore et al. Clin. Inf. Dis. 44: 441, 2007より作成。
治療開始基準となるCD4数を決めるための初の無作為比較試験の結果は2010年に発表された11)。しかし、CD4数200/μL未満群と200〜350/μL群との比較試験であったため、現在の開始基準に大きな影響を与えることはなかった。200/μL未満で治療開始した群では死亡率が有意に高く(ハザード比4.0、p=0.0011)、この試験は予定していた観察期間を待たずに中止されている。
無作為化された比較研究ではないものの、対照群を設定した国際共同コホート研究(NA-ACCORD)の解析が2009年に報告され12)、CD4数が351〜500/μLの時点で治療開始した群と、CD4数が350/μL以下になるまで治療開始を遅らせた群とを比較したところ、後者のほうが死亡率が高かった(相対危険度:1.69、95%CI:1.26 - 2.26)。別のコホート研究(ART-CC)を解析した報告でも13)、治療開始をCD4数が251〜350/μLになるまで遅らせた群は、351〜450/μLで治療開始した群よりもAIDS発症率および死亡率が高かった(相対危険度:1.28、95%CI:1.04-1.57)。より高いCD4数を持つ患者を対象としたコホート研究(CASCADE, 対象患者はCD4数800/μL未満)によると14)、CD4数が500/μL以上の場合では治療開始のメリットは認められなかったが、CD4数が350〜499/μLでは、治療を開始する方が遅らせるよりもAIDS発症および死亡のリスクが低下することが示された(調整ハザード比は0.75、95%CI:0.49-1.14)。
注目すべきことは、上述の海外のコホート研究から明らかになった死亡原因の大部分が、肝疾患、腎疾患、心疾患やAIDS指標疾患ではない悪性腫瘍など、いわゆる非AIDS関連疾患であったことである。この結果は、HIV感染者の生命予後を改善するためにはAIDS発症を阻止するだけでは不十分であることを示唆する。これを支持する証拠としてこれまでAIDSとの関連が明らかでなかった悪性腫瘍の発生がHIV感染者で健常人より多く発生し、比較的高いCD4数においてもこれが当てはまることを示す報告がある15-17)。その中には肛門癌や肝癌のようにウイルス感染が病態に密接に関連する腫瘍ばかりでなく、ウイルス感染とは無関係と考えられている肺癌、胃癌、腎癌、メラノーマ、白血病、ホジキン病なども含まれていた。さらに、HIV感染者では肝疾患、虚血性心疾患、腎疾患の合併またはそれに起因する死亡が健常者よりも多く見られ、その頻度がCD4数200〜350/μLの患者ではCD4数350/μL以上の患者よりも有意に高いことが4つの大規模なコホートにおいて証明されている18-23)。なかでも、SMART試験18)は、無作為割付の前向き臨床試験だったことから、有意な差が証明されたことが重視されている。これらの事実から、ARTは以前よりは早期に(多いCD4数で)開始し、より高いCD4数を保つことやHIVの増殖を抑えておくことが患者の長期予後にとって好ましいであろうと考えられるようになってきた24, 25)。
2015年に大規模な無作為比較試験の結果が発表された(START試験、TEMPRANO試験)。START試験はCD4数が500/μLを超える未治療患者4,685人を対象とし、観察期間(中央値)は3年、試験参加国は35か国に及ぶ26)。直ちに治療を行う群(早期開始群)とCD4数が350/μL未満になるまで治療を行わない群(治療待機群)に分けて比較したところ、主要評価項目である「重篤なAIDSまたは非AIDS疾患の発症、または死亡」は、早期開始群で42人(1.8%、0.6件/100人・年)であったのに対し、治療待機群では96人(4.1%、1.38件/100人・年)であり(ハザード比:0.43、95%CI:0.30-0.62、P <0.001)、早期治療の利点を裏付ける結果となった。このSTART試験の長期成績27)が2023年に発表された。2016年時点でCD4数中央値648/μLの早期開始群2160例とCD4数中央値460/μLの治療待機群2141例についての2016~2021年の5年間の観察期間の報告である。「重篤なAIDSまたは非AIDS疾患の発症、または死亡」は、早期開始群では89人(0.73件/100人・年)に対し治療待機群では113例(0.93件/100人・年)であり、ハザード比は0.79であった。治療待機群の早期開始群に対する超過リスクは、差が縮まっているものの長期成績においても持続していた。
TEMPRANO試験はコートジボアールで行われた無作為比較試験で、CD4数が800/μL未満の未治療患者を対象としている28)。すぐに治療を開始する群(早期開始群;CD4数の中央値は651/μL)とWHOの基準に従って治療する群(治療待機群;治療開始時のCD4数の中央値は408/μL)に分け、さらにそれぞれの群をイソニアジド(INH)予防内服の有無で2群に分けた。合計2000人以上の患者が対象となり、観察期間の中央値は30ヶ月であった。主要評価項目は「死亡、AIDS発症、非AIDS悪性腫瘍、非AIDS関連の浸潤性細菌感染症」である。その結果、これら臨床的イベントの発生リスクは早期開始群で低かった(ハザード比:0.56、95%CI:0.33-0.94)。
この点に関する日本のデータとしては、毎年HRD共同調査が行っているデータがある(HRD共同調査 2023年報告書、シミック株式会社)29)。2010年4月以降に治療開始した4,717名における治療開始時のCD4数別生存率をみると(図IV-2)、CD4数が500/μL以上で治療を開始した群は、500/μL未満で開始した群に比べ有意に生存率が高かった。
図 IV-2 ART開始時のCD4数と生存率(2010年4月以降に治療開始した症例)
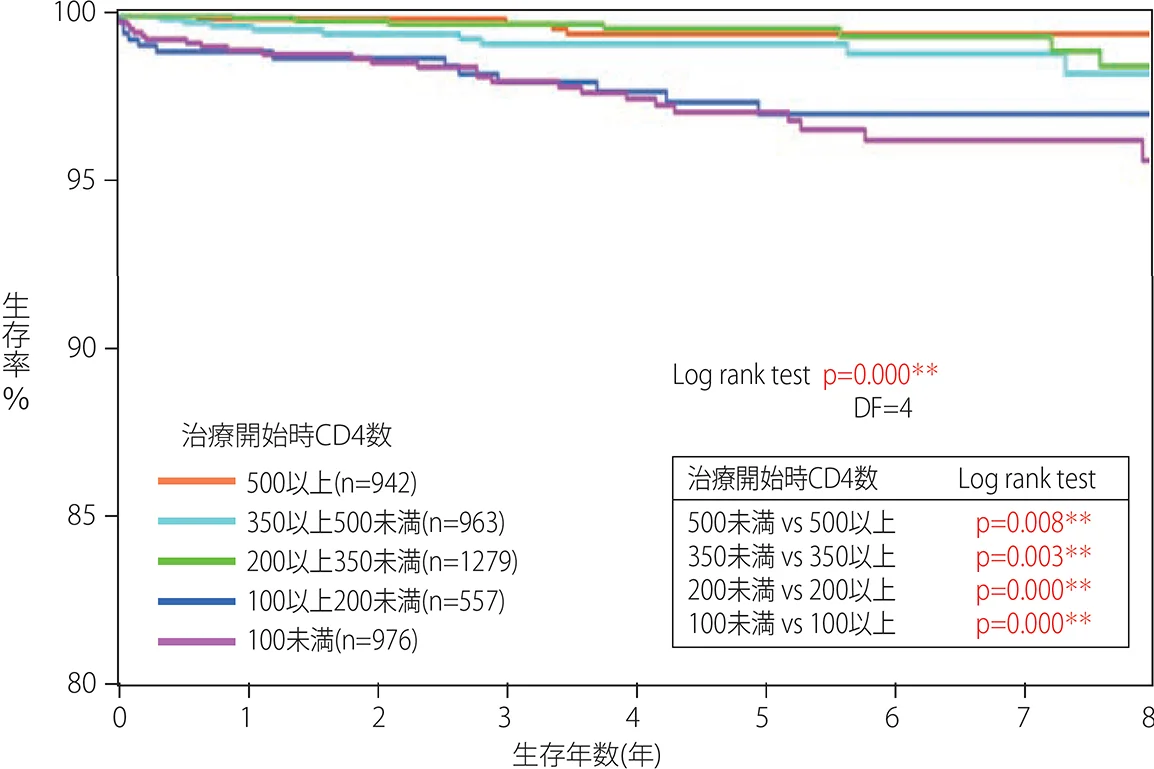
治療開始時のCD4数が不明の症例は除外した。
本解析では、群毎の患者背景(前治療歴の有無など)や治療内容(2剤以下の抗HIV療法の構成比など)による影響は考慮していない。
| 治療開始時 CD4数 |
生存者数 | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 0年 | 1年 | 2年 | 3年 | 4年 | 5年 | 6年 | 7年 | 8年 | |
| <100 | 976 | 866 | 758 | 652 | 541 | 437 | 282 | 204 | 155 |
| <200 | 557 | 502 | 458 | 387 | 322 | 269 | 180 | 124 | 97 |
| <350 | 1279 | 1153 | 1022 | 886 | 732 | 573 | 377 | 243 | 190 |
| <500 | 963 | 858 | 738 | 659 | 567 | 477 | 309 | 190 | 127 |
| 500≦ | 942 | 858 | 776 | 721 | 631 | 544 | 343 | 168 | 99 |
(4)予防としての治療
2011年に2次感染予防のための大規模な無作為比較試験(HPTN052)の結果が報告された30)。対象者は「CD4数350〜550/μLのHIV陽性者と、陰性者のカップル」であった。総数1763組を、直ちに抗HIV治療を行う群と、CD4数が250/μL以下もしくはAIDS発症するまで治療を行わない群に分けて比較したところ、すぐに治療を開始した群ではパートナーへの感染が96%減少していた。この試験によって「抗HIV治療は感染拡大の予防にもなる」ことが明確に示され、2016年に発表された最終結果でも93%の予防効果が示された31)。2014年には血中HIV RNA量200コピー/mL未満のHIV陽性者と陰性者のカップル(ヘテロセクシャル548組、MSM 340組)におけるコンドーム不使用の性行動でカップル間での感染が認められなかったという前向き観察研究(PARTNER試験)の結果が報告された32)。2017年には、HIV陽性者の血中HIVが抑制されておりHIV陰性者がPrEP(曝露前予防:pre-exposure prophylaxis)を用いない状況下においてコンドーム不使用のMSMの間で関連するHIV感染は認められなかったことが報告された(Opposite Attract試験)33)。