X免疫再構築症候群
4.対応方法
免疫再構築症候群を回避するための方法や免疫再構築症候群の発症時の対処方法は、未だに全てが確立したものとはなっていない。したがって、以下にはこれまでのエビデンスや経験から考えられる対応方法について述べる。
(1)抗HIV治療開始前の対応
抗HIV治療開始前には、日和見合併症の有無を評価しておくことが重要である。有症状時には見逃すことは少ないと思われるが、免疫再構築症候群として認める疾患は必ずしも事前に把握できていないこともあり8)(図X-3)、注意が必要である。胸部画像でみられた結節影が抗酸菌症や肺クリプトコックス症だと後日判明する症例を時に経験する。したがって、免疫不全の進行した症例、特にCD4数が50/μL未満の症例に抗HIV治療を開始する前には、眼底検査、胸部X線写真、脳MRI、血清診断としてβ-Dグルカン、クリプトコックス抗原、サイトメガロウイルス抗原(もしくは血中CMV-DNA定量)およびインターフェロンγ遊離試験(IGRA)などを検査しておくと良い。Elliottら26)は抗HIV治療開始前にIGRAが陽性である場合には結核のunmasking IRIS発症の予測に役立つと報告し、Jarvisら27)は抗HIV治療開始前の血漿クリプトコックス抗原が陽性の場合には抗HIV治療開始後1年以内のクリプトコックス髄膜炎発症を予測すると報告しており、抗HIV治療開始前の抗原検査など有用性が示されている。
図X-3 免疫再構築症候群を起こした疾患の既往の有無
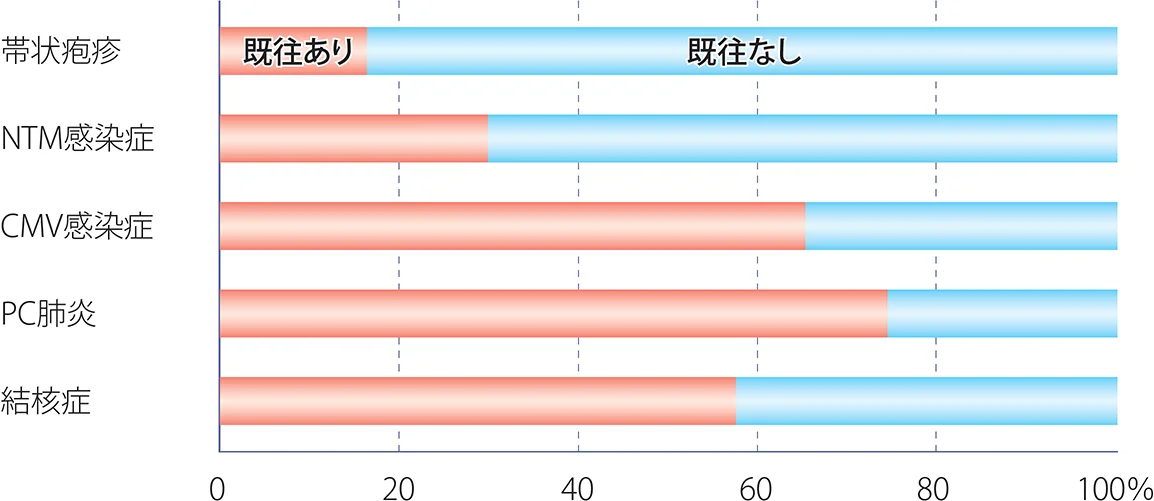
また、日和見感染症を未発症の場合でもCD4数が50/μL未満で抗HIV治療を開始していない症例には非結核性抗酸菌(Mycobacterium avium complex)症28)、200/μL未満の症例にはニューモシスチス肺炎の予防をすることで、病原体抗原量を減少させ、免疫再構築症候群の発症リスクを減らすことができる可能性がある。
抗HIV治療開始前に発症した日和見合併症の治療後、いつから抗HIV治療を始めるかについてもはっきりした結論は出ていない。免疫再構築症候群を回避するためには、体内の病原体の抗原量を十分に減らしてから抗HIV治療を開始することが望ましいが、免疫不全の進行した症例で抗HIV治療開始をいたずらに遅らせることは、日和見合併症の発症リスクがあり、悩ましい問題である2)。わが国においては現在のところ、ニューモシスチス肺炎、サイトメガロウイルス感染症の場合は3週間の治療終了後、非結核性抗酸菌症、結核症の場合は、1〜2ヵ月間の治療後に抗HIV治療を始める傾向にある。一方、特異的な治療薬がない進行性多巣性白質脳症や化学療法を行うカポジ肉腫などでは、早期に抗HIV治療を導入する。
表X-8には、米国の日和見感染症ガイドライン29)に記載されている主な日和見疾患発症時の抗HIV治療開始時期を示す。エビデンスの根拠となった無作為化試験の一部は低・中所得国で実施された古い臨床試験であることにも留意する。
表X-8 日和見感染症発症時の抗HIV治療開始時期
| 日和見 |
抗HIV治療 |
推奨 |
備考 |
|---|---|---|---|
| ニューモシスチス肺炎 | 2週以内 | AI | 呼吸不全例のデータは不足 |
| 結核症 | CD4<50/μL:2週以内 CD4≧50/μL:2~8週以内 |
AI | 髄膜炎症例は下記参照 薬物相互作用に注意 |
| 結核性髄膜炎 | 少なくとも2週以降 | AIII | 病勢のコントロール後 |
| 播種性MAC症 | 早期(可能なら同時に開始) | BIII | 薬物相互作用に注意 |
| CMV感染症 | 1~2週以内 | CIII | 早期開始ではIRISのリスクは上昇 |
| クリプトコックス髄膜炎 | 4~6週 | AI | 低細胞数(5 cells/μL)の症例は注意 開始時の培養陰性でIRISのリスク低下 |
| 他のクリプトコックス症 | 2週 | BIII | 最適な開始時期は不明 |
| トキソプラズマ脳炎 | 2~3週以内 | - | データ不足 |
| 進行性多巣性白質脳症 | できるだけ早期に | AII | IRISにはステロイド治療を行うが、最適な投与量・投与期間は未確立 |
海外からは日和見感染症を発症した症例においても早期に抗HIV治療を開始することの意義が報告されている。Zolopaら30)は、日和見感染症治療開始後14日以内に抗HIV治療を開始する早期導入群の方が抗HIV治療を遅らせて始める群に比べ新たなAIDS指標疾患の発症や死亡が有意に少なく、免疫再構築症候群の発症率に差がないことを報告している(ACTG A5164 study)。2019年にはトキソプラズマ症とニューモシスチス肺炎発症例を対象にした無作為化・前向き研究が報告され、日和見感染症治療開始後7日以内に抗HIV治療を開始する早期導入群と日和見感染症治療終了後に抗HIV治療を開始する待機群では免疫再構築症候群や他の合併症の発症率、免疫学的およびウイルス学的治療効果に有意差はないと記されている31)。わが国のHIV診療医は日和見感染症の病状が安定した後に抗HIV治療を開始する傾向にあるが、2週以内を治療開始時期であると考える者も増えてきている(図X-4)。
図X-4 HIV診療医93名の抗HIV治療導入時期に関する考え方
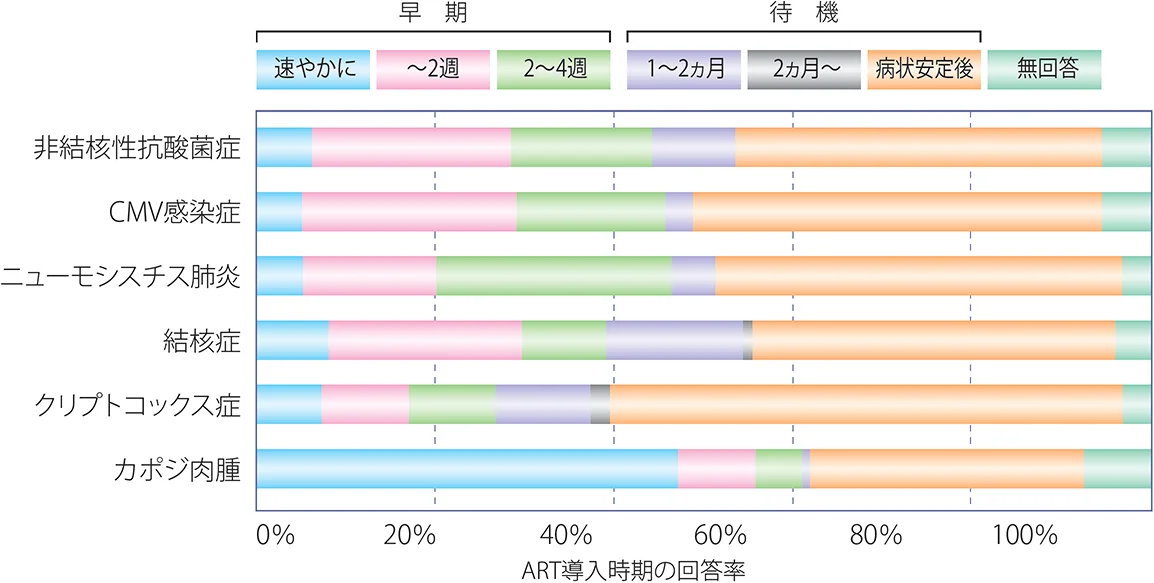
反対に、抗HIV治療の開始時期を遅らせたほうが良い病態もある。IAS-USA Panelガイドラインでも日和見感染症合併症例では出来れば2週以内の早期に抗HIV治療を導入することを勧めている一方で、クリプトコックス髄膜炎と結核性髄膜炎の症例では慎重に対応することが記載されている32)。
クリプトコックス髄膜炎合併AIDS症例に対して複数の無作為化試験33)が低・中所得国で実施されたが、現在で推奨されている抗真菌治療とは異なった治療法の選択などの課題が存在した。Boulwareら34)は抗HIV治療早期群と待機群で免疫再構築症候群の発症率には有意差はないが、26週までの死亡率は早期群の方が有意に高いと報告している。これらの結果からDHHSガイドライン29)ではクリプトコックス髄膜炎合併症例における抗HIV治療導入時期は抗真菌薬開始から4〜6週後を推奨(AI)している。一方で、高所得国での観察研究35)では抗HIV治療を2週間以内に開始することと死亡率の増加との関連性は見出せなかった。リソースが整った環境における十分なエビデンスは存在しない。
Abayら36)は、結核合併AIDS症例の抗HIV治療開始時期に関する6つの臨床試験をメタ解析し、抗結核治療開始後早期に抗HIV治療を始めることで免疫再構築症候群の発症率は高くなるが、全死亡を有意に減少させ、特にその傾向はCD4数が50/μL未満症例で顕著であることを報告している(表X-9)。Liら37)のメタ解析結果では、抗結核治療開始後早期に抗HIV治療を始めることで免疫再構築症候群の発症率、全死亡ともに増加させたと報告されている。前述(表X-8)の通りDHHSガイドライン29)では、髄膜炎のない結核症でCD4数が50/μL未満の場合は結核治療後2週間以内(AI)に抗HIV治療を開始することを強く推奨し、50/μL以上の場合は2〜8週以内(AI)に、結核性髄膜炎では少なくても2週以降(AIII)に抗HIV治療を開始することを勧めている。しかし、実臨床では推奨期間に抗HIV治療を開始することが困難なことも多い。渡邉ら38)はCD4数が50/μL未満のHIV感染症合併結核患者18例で2週以内に抗HIV治療を開始できた症例は3例(16%)であったが、抗HIV治療が遅れても予後への影響は少なかったと報告している。また抗HIV治療が遅れる原因は抗結核薬の副作用が最も多かったと指摘している。
表X-9 結核治療とART開始時期に関する比較試験のメタ解析結果
| 結果 | 早期 |
待機 |
リスク |
95% |
|---|---|---|---|---|
| 全死亡 | 117/1153 | 145/1119 | 0.78 | 0.63-0.98 |
| 結核の |
396/634 | 376/606 | 0.99 | 0.92-1.08 |
| TB-IRIS* |
231/1153 | 103/1119 | 2.19 | 1.77-2.70 |
| TB-IRIS |
9/1153 | 0/1119 | 6.94 | 1.26-38.22 |
| 薬物の |
575/1153 | 571/1119 | 1.00 | 0.93-1.08 |
| 新たな |
54/707 | 64/678 | 0.84 | 0.60-1.18 |
免疫再構築症候群の予防効果についても検討が行われている。プラセボと比較した無作為化二重盲検試験では、結核のparadoxical IRISに対するプレドニゾロンの予防効果を認めた(推奨度はXI章参照)39)。一方で、クリプトコックス髄膜炎を対象とした無作為化二重盲検試験では、デキサメタゾン投与によって死亡率や免疫再構築症候群の発生率は変わらず、有害事象が増加し、髄液のクリプトコックスの陰性化は遅延した40)。
(2)免疫再構築症候群への対処
免疫再構築症候群を発症した場合も、有効な抗HIV治療をできる限り継続するように対応することが基本である。図X-5には、HIV感染者に炎症性病態の増悪をみた場合の考え方、対応をフローチャートで示す5)。
図X-5 免疫再構築症候群に関連した対応のアルゴリズム
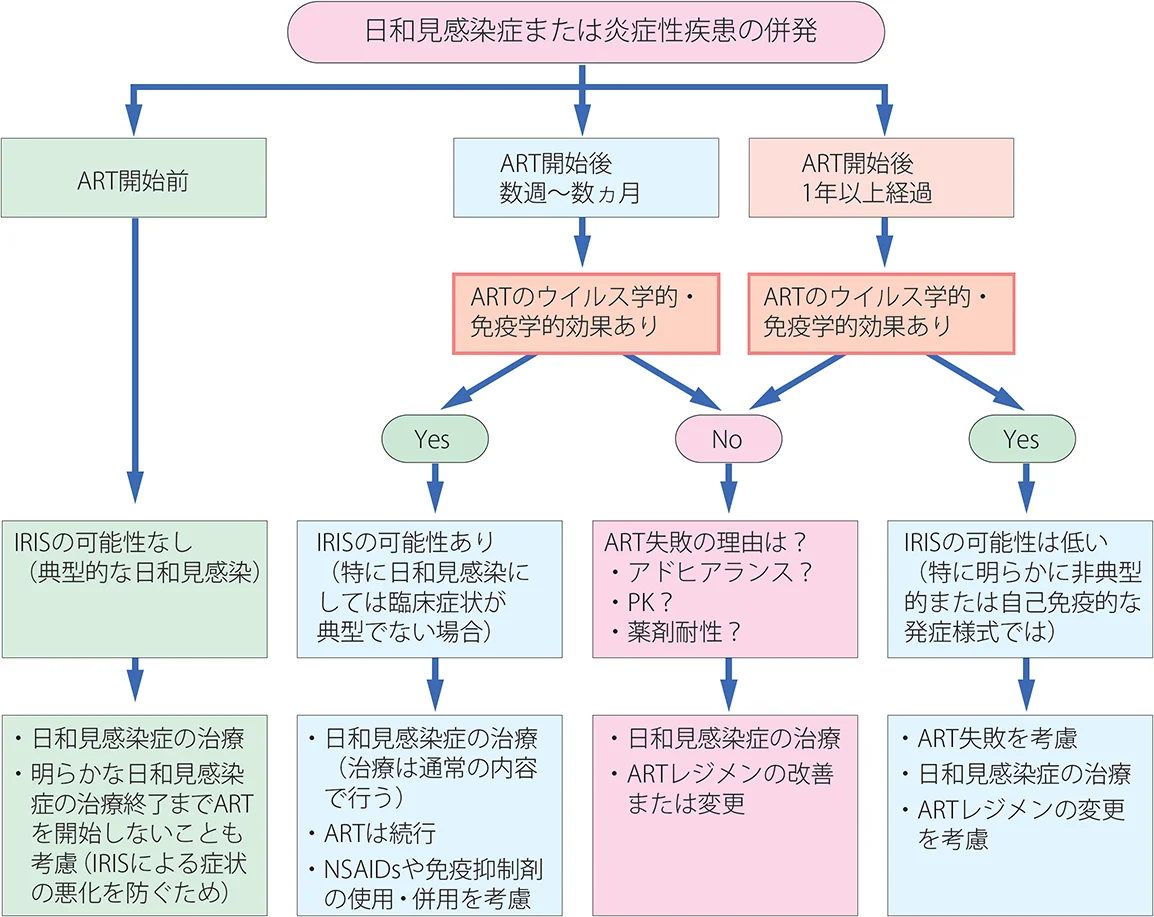
Stoll et al. Curr Infect Dis Rep 5: 266, 2003から引用
免疫再構築症候群への対処方法には、その疾患自身に対する治療と過剰な炎症のコントロールとがある。疾患が感染症である場合には、病原体の増殖がなければ、抗微生物薬の投与は不要とする考え方もある41)。しかし、臨床的に病原体の増殖がないことを証明することは難しく、免疫再構築症候群の病態が軽症で経過をみることができる場合を除けば、抗微生物薬の継続や開始が必要であり、治療経過によっては抗微生物薬の追加・変更を考慮する場合もある。炎症のコントロールの方法には、NSAIDsや副腎皮質ステロイド薬の投与がある。副腎皮質ステロイド薬は、臓器の機能障害が重篤な場合、生命の危機がある場合、他の方法が無効な場合などに考慮する。副腎皮質ステロイド薬の投与方法も決まったものはないが、プレドニゾロン1〜2mg/kg/日相当で1〜2週継続後に週から月単位で減量する方法などがある(BII)42-44)。ただし、カポジ肉腫の免疫再構築症候群の管理に副腎皮質ステロイド薬の使用は推奨されていない29)。
免疫再構築症候群のために抗HIV治療を中止せざる得ないこともあるが、その基準も決まっていない。現時点では、抗HIV治療を継続することで免疫再構築症候群の病態が生命を脅かす場合や副腎皮質ステロイド薬が無効な場合などに、抗HIV治療の中止を考慮する(AIII)。
Haddowら45)は抗HIV治療を開始した成人498名を24週間フォローする前向き調査を実施したところ、114名(22.9%)で免疫再構築症候群を発症した。フォロー期間の死亡例25名中6名(24%)、抗HIV治療薬の変更・中断例35名中10名(29%)、入院例65名中13名(20%)は免疫再構築症候群が原因であった(図X-6)。少し古い検討ではあるが、免疫再構築症候群が入院、抗HIV治療の中断や死亡につながることもあるので、そのマネジメントは臨床上重要な課題となる。
図X-6 抗HIV治療後24週以内にみられた有害事象とその原因
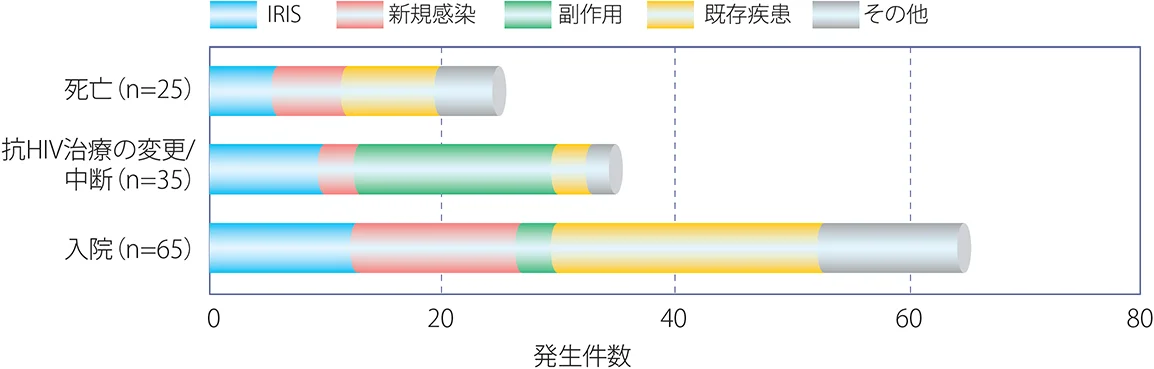
Haddow et al. PLOS ONE 7, 2012から引用