10.HBV再活性化
①免疫抑制・化学療法時
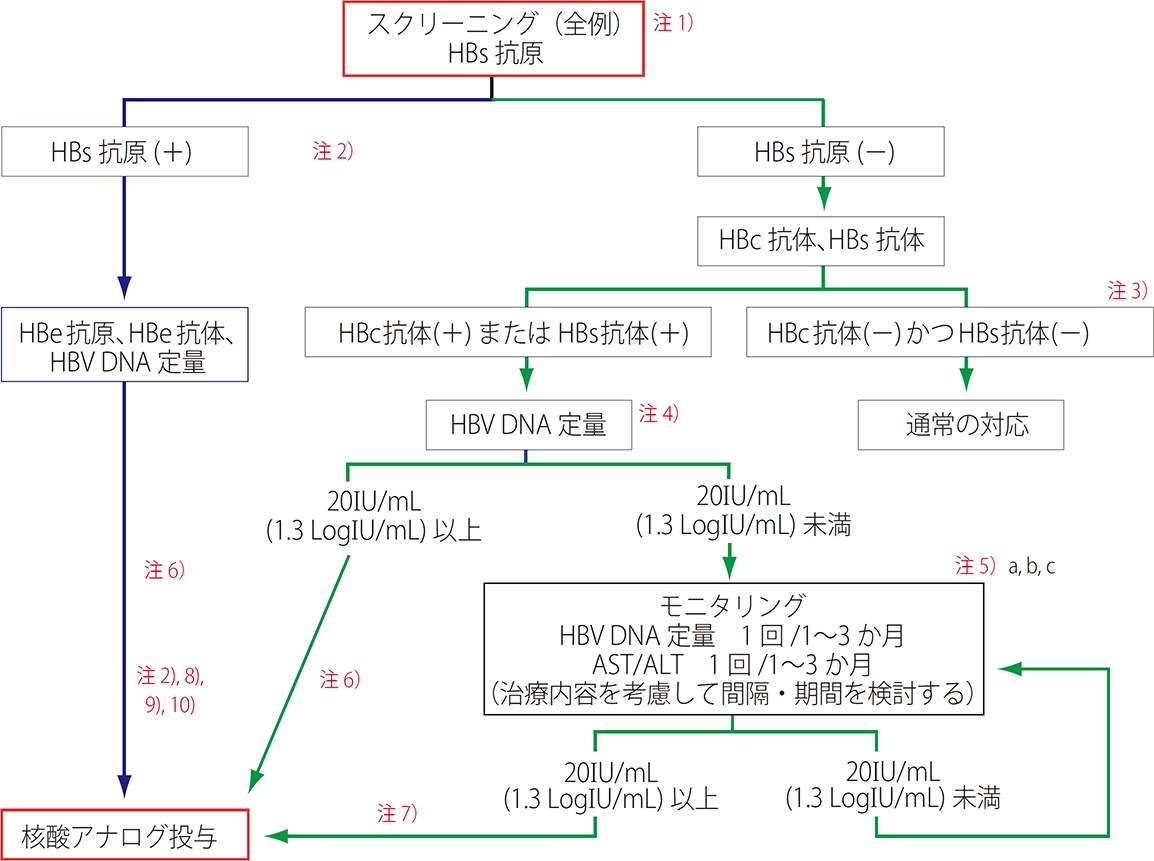
HIV/HBV共感染に限らずHBV感染患者において免疫抑制・化学療法などにより HBV が再増殖することがある。これはHBV 再活性化と称し、各肝臓疾患ガイドライン16-18)において重要事項と位置付けられており、日本肝臓学会B型肝炎治療ガイドライン18)から引用して本章に掲載する。HBV再活性化はキャリアからの再活性化と既往感染者(HBs 抗原陰性、かつ HBc 抗体または HBs 抗体陽性)からの再活性化に分類される。既往感染者からの再活性化による肝炎は、「 de novo B 型肝炎」と称される。 HBV 再活性化による肝炎は重症化しやすいだけでなく、肝炎の発症により原疾患の治療を困難にさせるため、発症そのものを阻止することが最も重要である。免疫抑制・化学療法を行う際には図XII-1にそった対策をとる必要がある。この対策は厚生労働省研究班による「免疫抑制・化学療法により発症するB 型肝炎対策ガイドライン(改訂版)」30, 31)に基づいている18)。なお、DHHSガイドラインでは、免疫抑制・化学療法を開始する前にHBs抗原陽性であれば、TDF もしくは TAF と 3TC もしくは FTCをバックボーンにしたARTを開始しておくとしている14)。また、HBc抗体単独陽性の場合には、エビデンスはないが同様にARTを開始しておくことが賢明であるとしている(BIII)14)。何らかの理由でTDFもしくはTAFが使用できない場合には、それらを含まないARTレジメンにエンテカビルを併用して開始しておくか、モニタリングでHBV DNAが検出されるなどの再活性化の兆候が見られた時点でエンテカビルを併用する14)。適切な治療期間に関する研究は行われていないが、AASLD 2018 Hepatitis B Guidanceでは、免疫抑制療法中止後6ヵ月間、抗CD20抗体薬の場合は中止後12ヵ月間治療を継続するよう推奨している(BIII)16)。日本肝臓学会B型肝炎治療ガイドラインにはHBV再活性化について注意喚起のある薬剤が掲載されているが、新規薬剤に関する HBV 再活性化に関する情報は、医薬品医療機器総合機構による副作用情報(https://www.pmda.go.jp/safety/info-services/drugs/adr-info/0001.html)などで確認していただきたい18)。
②HCV治療時
HIV/HBV/HCV重複感染者において肝線維化の進行が加速しHCCのリスクが高くなるため32-34)、両方の肝炎ウイルスの治療をすることが薦められる13,14)。直接作用型抗ウイルス薬(DAAs)によるHCV治療中にHBVの再活性化がおきることがあるため 35-38)、抗HBV活性を含むARTレジメンで治療をしておく(AIII)13,14)。
図XII-1 免疫抑制・化学療法により発症するB型肝炎対策ガイドライン